Slika: Personalizirani pristup liječenju MS
Piše: Prim. prof. dr. sc. Inge Klupka Sarić, dr. med., spec. neurolog
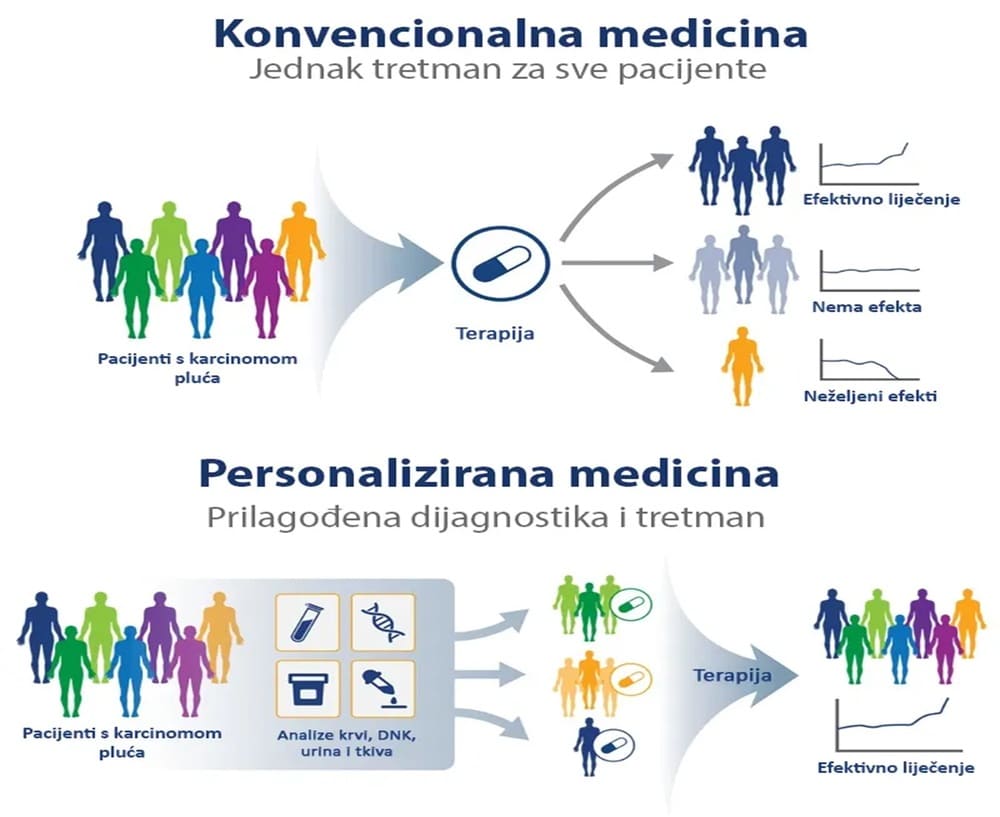
Personalizirana ili precizna medicina relativno je novi medicinski model koji je usmjeren prema pacijentu kao prema jedinstvenoj jedinki. Može se definirati i kao niz postupaka koji se primjenjuju prema potrebama pacijenta na osnovu karakteristika njegovih gena, fenotipa, psihosocijalnog stanja, bioloških biljega te njegove obiteljske i zdravstvene povijesti. Glavni postulat personalizirane medicine je „prava terapija za pravog pacijenta u pravo vrijeme“ koji ukazuje na novi način liječenja bolesti i na revolucionarni napredak u zdravstvu. Precizna medicina danas se kao pristup liječenja upotrebljava u mnogim područjima medicine, a poseban napredak je ostvaren u području onkologije i farmakologije. Farmakogenetika je ključna komponenta u personaliziranoj medicini koja proučava genetski uvjetovane varijacije u odgovoru na lijekove te omogućuje bolje razumijevanje učinka lijeka i njegove nuspojave, odnosno nastoji razumjeti koji lijek pruža najveću korist, a koji može imati najveći rizik od komplikacija. Model personalizirane medicine ima za cilj: unaprijediti prevenciju, što ranije otkrivanje bolesti, optimiziranje učinka liječenja, smanjenje nuspojave, izbjegavanje nepotrebnih tretmana, te smanjenje troškova liječenja… Ovakav pristup predstavlja odmak od tradicionalnih metoda liječenja kod kojih se koristi „jedan lijek za sve“ ka ciljanom liječenju krojenom prema specifičnim potrebama svakog pojedinog pacijenta, tj. ka paradigmi „pravi lijek za pravog pacijenta u pravo vrijeme“.
Pomak prema personaliziranoj medicini nije se dogodio preko noći. O važnosti načela personalizirane medicine počelo se govoriti prije više od 2000 godina kada je Hipokrat u svojim radovima odvojio medicinu od magije i praznovjerja te je pokrenuo prema znanstvenoj personaliziranoj medicini. U novije vrijeme, značajne promjene u društvu uvjetovane prvenstveno otkrićem interneta pružaju široku dostupnost medicinsih podataka koji su nekad bili dostupni samo liječnicima, što pacijenta čini aktivnijim sudionikom i posljedično zatijevnijim u personaliziranju njegovog liječenja.
Personalizirana medicina i multipla skleroza (MS)
S obzirom da je MS vrlo heterogena bolest te klinička slika varira od pacijenta do pacijenta, nosi naziv “bolest sa hiljadu lica“. Osim osnovne podjele prema kliničkoj slici na relapsirajuću i progresivnu formu, postoje vrlo značajne razlike unutar iste grupe kao i značajna varijabilnost reakcija na imunomodulirajuća sredstva, zbog čega liječnje multiple skleroze zahtijeva individualan/personaliziran pristup.
Osnovni koncept za dijagnostiku MS je koegzistencija kliničkih znakova i neuroradiološkog nalaza (magnetne rezonancije – MRI) koji ukazuju na diseminaciju u prostoru (engl. DIS); i diseminaciju u vremenu (engl. DIT).
Zbog složenosti i heterogenosti ove bolesti, postavljanje dijagnoze, liječenje i procjena budućeg toka bolesti za svakog pojedinog pacijenta predstavlja izazov. Dijagnoza MS najčešće se postavlja onda kada je klinička slika već prisutna te su uočljive demijelinizacijske lezije na MRI. Međutim, primjena kliničkih i slikovnih biomarkera trenutno ne omogućava individualnu karakterizaciju i predviđanje toka bolesti. Zbog toga se sve veći značaj daje otkrivanju biomarkera za MS kojim će se bolest moći predvidjeti, ranije dijagnosticirati, odrediti tip MS, pratiti tok bolesti i učinkovitost terapije. Već se desetljećima traga za dobrim biomarkerima koji bi bili specifični i osjetljivi za MS, ekonomični i neinvazivni. Unatoč velikom broju studija i dugom popisu biomarkera kandidata, danas je vrlo mali broj biomarkera od kliničke vrijednosti, a i oni koji to jesu, u mnogim sredinama se ne koriste iz ekonomskih razloga.
Prediktivni biomarkeri
Prediktivni biomarker je onaj biomarker koji predviđa, izražava mogućnost za razvijanje pojedine bolesti prije nego ona sama nastupi i bude dijagnosticirana. Primjer za to su npr. biomarkeri iz uzorka krvi koji mogu procjeniti potencijalnu progresiju optičkog neuritisa u MS. Radi se o dva epitopa antitijela koji predviđaju rizik od razvoja MS nakon pojave optičkog neuritisa.
Ono što je već poznato jest da su HLA geni povezani s nastankom MS. Najveći i prvi identificirani genetski faktor rizika je alel iz gena HLA-DRB1 klase MHC klase II, HLADRB1*15:01, koji povećava rizik od MS oko tri puta, a upravo zbog toga može biti prediktivni genetički biomarker za MS.
U novijim studijama testirani su obrasci antitijela kod onih s MS-om i onih bez bolesti. Otkriveno je da su mnogi od onih koji su razvili MS imali poseban obrazac autoantitijela, koji su nazvani ‘imunogeni klaster’ koji je ostao stabilan tokom vremena, a ta autoantitijela nisu pronađena u kontrolnoj grupi. S obzirom na njegovu specifičnost za MS i prije i nakon dijagnoze, serološki test autoantitijela mogao bi se implementirati u nadzornom okruženju za pacijente s velikom vjerojatnošću razvoja MS-a, ili kod prve klinički izolirane neurološke episode. Pretpostavlja se da bi taj potpis antitijela mogao imati i druge namjene kao npr. biti marker ozbiljnosti bolesti i objasniti neke od heterogenih karakteristika MS-a (kliničkih značajki, genetike, patogeneze i reakcije na liječenje).
Dijagnostički biomarkeri
Ranije spominjane oligoklonalne vrpce, IgG indeks su biomarkeri dijagnoze MS u kliničkoj praksi. Trenutno se MS ne može dijagnosticirati laboratorijskim određivanjem jednog parametra i čini se kako to još uvijek u skoroj budućnosti neće biti moguće, već će za dijagnostiku biti potreban panel biomarkera.
Neki od potencijalnih dijagnostičkih biomarkera su: autoantitijela na fragmente mijelinskog bazičnog proteina, Lambda i kapa slobodni laki lanci, Dušikov oksid (NO) i njegovi metaboliti , kisikovi reaktivni spojevi, glijalni fibrilarni kiseli protein (engl. GFAP), topiva molekula Nogo-A (mijelinska komponenta SŽS-a koja inhibira popravak axona) itd.
Značajnu ulogu u dijagnostičkom procesu bi mogao imati N-acetil aspartat (NAA) čije su razine u serumu i u cerebrospinalnoj tekućini bile značajno veće u bolesnika s RRMS-om, u usporedbi sa kontrolama i pacijentima s NMO-om (neuromijelitis optica). Stoga bi biomarker NAA mogao biti od pomoći i u diferencijalnoj dijagnozi između MS i NMO. (Toscano i Patti, 2021; Katsavos i Anagnostouli, 2013).
Prognostički biomarkeri
Biomarkeri za prognozu MS mogu pružiti informacije o tijeku aktivnosti bolesti i ukazati na konverziju u drugi oblik MS, na primjer iz CIS-a u RRMS ili iz RRMS u SPMS.
Tok bolesti za sada predviđamo/pretpostavljamo uglavnom na osnovu kliničkih, MRI i demografskih parametara kao rijetkih, nama trenutno dostupnih biomarkera kao oligoklone vrpce IgG, OCT, neurofilamenti.
Detekcija oligoklonalnih vrpca IgG u likvoru povezana je s pretvorbom iz CIS-a u MS i stoga se može opisati kao biomarker za prognozu MS.
Neurofilamenti (NF) su neuronski citoskeletni proteini koji se sastoje od lakog (NFL), srednjeg (NFM) i teškog (NFH) lanca. Ako dođe do aksonskog ili neuronskog oštećenja, oslobađaju se NF i mogu se otkriti u likvoru i krvi. Pacijenti s MS-om imaju povišene razine NFL-a u usporedbi s kontrolnom skupinom. Razine NFL-a u serumu također koreliraju s novim MRI lezijama, stupnjem invaliditeta i stopom atrofije mozga. Nadalje, NFL je također prikladan kao biomarker za konverziju iz CIS-a u MS. Općenito, određivanje serumske koncentracije NFL-a, korelira s mnogim kliničkim karakteristikama MS te se stoga može koristiti kao prognostički biomarker u kliničkoj praksi. S druge strane, lanci NFH bolje koreliraju s progresijom bolesti, pri čemu je značajno povišenje zabilježeno samo u progresivnim oblicima bolesti
Istražuju se ili, u nekim sredinama, već koriste brojni prognostički biomarkeri od kojih ćemo nabrojati samo neke: oligoklonalne vrpce IgM u likvoru, protein CHI3L1 MMP, mijelin bazični protein, adhezijska molekula neuronske stanice NCAM, Tau protein itd.
Biomarkeri terapijskog odgovora
Zahvaljujući progresivnom rasvjetljavanju patofiziologije MS, sada su dostupni brojni načini liječenja koji mijenjaju tijek bolesti sa specifičnim mehanizmima djelovanja. Međutim, ne reagiraju svi pacijenti jednako na liječenje. Kako bi se svaki pacijent mogao liječiti individualno optimiziranim liječenjem MS u pravo vrijeme, potrebno je poznavati biomarkere za predviđanje terapijskog odgovora i praćenje njegove učinkovitosti. Unatoč velikim naporima znanstvenika, potraga za takvim biomarkerima još uvijek nije dala očekivane rezultate.
Biomarkeri koji se već koriste ili bi se mogli koristiti u praćenju učinkovitosti terapije su:
– Neutralizirajuća antitijela u terapiji interferonom-β (IFN-β) i natalizumaba
– Budući da je oslobađanje NFL-a povezano s nastankom oštećenja aksona, koncentracija NFL korelira s aktivnošću bolesti, protein bi mogao biti takav biomarker za terapijski odgovor. Nekoliko je studija već pokazalo prosječno smanjenje količine NFL-a u cerebrospinalnoj tekućini pacijenata s MS-om nakon liječenja natalizumabom, fingolimodom, mitoksantronom ili rituksimabom ili alemtuzumabom.
Prema studijama, pacijenti na terapiji s natalizumabom imali su niže vrijednosti CXCL13 (eng. C-X-C motif chemokine ligand) od pacijenata koji su primali terapiju IFN-β. Prema tim rezultatima, CXCL13 bi mogao biti prikladan biomarker za učinkovitost terapija kod MS.
U istraživanju Hegen i sur. otkrivana su četiri različita tipa imunološkog odgovora kod bolesnika s MS, što bi moglo biti od koristi pri izboru selektivnog liječenja za određenog bolesnika.
Američko istraživanje provedeno na 164 bolesnika s MS pokazalo je da se pomoću optičke koherentne tomografije (OCT) može procijenti koliko brzo bolest napreduje.
Optička koherentna tomografija (OCT) je jednostavna neinvazivna, nekontaktna metoda laserskog slojevnog snimanja mrežnice i vidnog živca. Prema mišljenju stručnjaka, na živčanim vlaknima mrežnice trebali bi se uočiti najraniji znakovi oštećenja usljed MS. Brzina propadanja tih živčanih vlakana korelira sa napredovanjem MS pa se smatra da mjerenje stanjenja mrežnice može pomoći u procjeni koliko je neka terapija uspješna u usporavanju napredovanja multiple skleroze.
Osim praćenja učinka terapije na bolest nužno je predvidjeti i prevenirati nuspojave. U tom smislu, osim kliničkog, neuroradiološkog i praćenja rutinskih laboratorijskih parametara, u praksi je praćenje titra antitijela JC virusa u terapiji natalizumabom i određivanje CYP2C9 metaboličkog statusa pacijenta u terapiji siponimodom.
Na kraju, možemo reći da je personalizirani pristup u medicini zdravstvo s ljudskim licem, gdje je svaki pacijent prepoznat kao jedinstvena osoba sa jedinstvenim potrebama. Nadamo se da ćemo ovakav pristup moći primjenjivati u sve većoj mjeri u liječenju MS pacijenata.
Reference:
1. Bašić Kes V i sur. Multipla skleroza. Zagreb, Medicinska naklada, 2021, str. 1-62, 125.
2. Huzjak V. Personalizirana ili precizna medicina [Završni rad]. Zagreb: Zdravstveno veleučilište; 2022 [pristupljeno 20.12.2024.] Dostupno na: https://urn.nsk.hr/urn:nbn:hr:139:687692
3. Sedić, Mirela ; Kraljević Pavelić, Sandra ; Pavelić, Krešimir ; Personalizirana medicina – temeljni koncepti i primjena // Sekundarna prevencija u pedijatriji : zbornik radova. Slavonski Brod: Odjel za dječje bolesti Opće bolnice, 2011. str. 13-28
4. Toscano, S.; Patti, F. CSF biomarkers in multiple sclerosis: beyond neuroinflammation. Neurosciences. 2021, 8, 14-41.
5. Arneth B, Kraus J. Laboratory biomarkers of Multiple Sclerosis (MS). Clin Biochem, 2021, 21, 275-277.
6. Sun H, Shen XR, Fang ZB, Jiang ZZ, Wei XJ, Wang ZY, Yu XF. Next-Generation Sequencing Technologies and Neurogenetic Diseases. Life (Basel), 2021, 11(4), 361.
7. Sadam H, Pihlak A, Jaago M, et al. Identification of two highly antigenic epitope markers predicting multiple sclerosis in optic neuritis patients. EBioMedicine. 2021;64:103.
8. Parnell GP, Booth DR. The Multiple Sclerosis (MS) Genetic Risk Factors Indicate both Acquired and Innate Immune Cell Subsets Contribute to MS Pathogenesis and Identify Novel Therapeutic Opportunities. Front Immunol. 2017;8:425.
9. Katsavos S, Anagnostouli M. Biomarkers in Multiple Sclerosis: An Up-to-Date Overview. Mult Scler Int, 2013, 2013, 1-20.
10. Nourian NA. Molecular Biomarkers in Multiple Sclerosis. Journal of Reviews in Medical Sciences, 2021, 1, 117-127.
11. Hegen H, Walde J, Berek K, et al. Cerebrospinal fluid kappa free light chains for the diagnosis of multiple sclerosis: A systematic review and meta-analysis. Mult Scler. 2023;29(2):169-181.